大家好,本周为大家分享一篇发表在Analytical Chemistry上的文章,Ion Mobility-Mass Spectrometry and Collision-Induced Unfolding of Designed Bispecific Antibody Therapeutics1,文章的通讯作者是密歇根大学的Brandon副教授。
双特异性抗体(bispecific antibodies, bsAbs)是一类重要的新兴疗法,能够同时靶向两种不同的抗原,已被开发作为对某些单克隆抗体疗效有限疾病的治疗手段。尽管bsAbs具有独特的优势,但它的结构较为复杂,需要特殊的制备工艺,“knobs-into-holes”(KiH)是其中一种可以用于制备bsAbs的技术,这种技术通过将knob链CH3结构域表面的特定氨基酸突变为较大氨基酸,将hole链上的突变为较小氨基酸,从而实现“knobs-into-holes”的配对形式,提高不同轻重链在配对时的正确配对率,产生正确的bsAbs。然而,由于抗体治疗药物分子量较大,通常比传统的小分子药物表现出更大的结构复杂性和异质性,对KiH bsAb 高级结构的完整表征对定义bsAb的结构功能关系,以及确保最终治疗的稳定性、有效性和安全性都至关重要。目前已开发的分析方法有很多,但是普遍存在样品消耗量大、数据采集和解析时间较长等缺点。
近年来,非变性离子迁移质谱(ion mobility-mass spectrometry, IM-MS)和碰撞诱导去折叠(collision-induced unfolding,CIU)逐渐被证实是用于分析单克隆抗体高级结构的有效方法,能够从存在结构异质性和杂质的几微克样品中表征单抗治疗药物的高级结构。IM可以根据气相蛋白离子的电荷和旋转平均碰撞截面(collision cross sections,CCSs)在毫秒时间尺度上对蛋白进行分离。当与质谱耦合时,可以很容易地将质荷比相同但CCS不同的离子区分开来,而CIU可以使IM-MS同步提供蛋白质结构和构象稳定性信息。CIU根据二硫键、糖基化水平、结构域交换特性等信息来区分差异。
在这篇文章中,作者描述了定量CIU在bsAbs中的首次应用,扩展了非变性IM-MS和CIU的能力,用于稳定表征KiH bsAb及其亲本knob和hole同型二聚体单抗的高级结构。
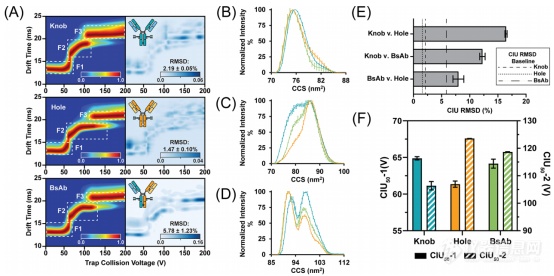
图1 Native、未修饰的knob(蓝色)和hole(橙色)同型二聚体,以及KiH bsAb异型二聚体(绿色)的CIU实验。(A)24+电荷态(左)及其相应重复RMSD基线(右)的平均CIU指纹图谱(n=3)。所有的指纹图谱都显示了白色虚线框所示的三个主要特征。在(B) 5 V、(C) 65 V、(D) 110 V时的标准化TWCCSN2分布。在较低的激活电位下,所有抗体均具有相似的CCS,在较高的加速电位下则存在显著差异。(E)两两的RMSD分析显示,与重复的RMSD基线(虚线)相比,抗体之间的整体高级结构差异。(F)CIU50分析说明了KiH bsAb模型的稳定性如何保持在knob和hole的同型二聚体之间。
如图1所示,bsAb的稳定性似乎与本文研究的KiH模型的两个亲本同型二聚体单克隆抗体相关。在电压为65V时,KiH bsAb的TWCCSN2分布与亲本knob同型二聚体单抗的分布相似;而在110V时,则与亲本hole同型二聚体单抗的分布相似。并且KiH bsAb的稳定性介于两种亲本同型二聚体单抗的稳定性之间。与指纹图谱中记录的第一次CIU转换相对应的是CIU50-1值,第二次的则是CIU50-2值,从3组样本的数据分析推测,CIU50-1和CIU50-2很可能代表了KiH bsAb和mAb结构中不同结构域的局部稳定性。
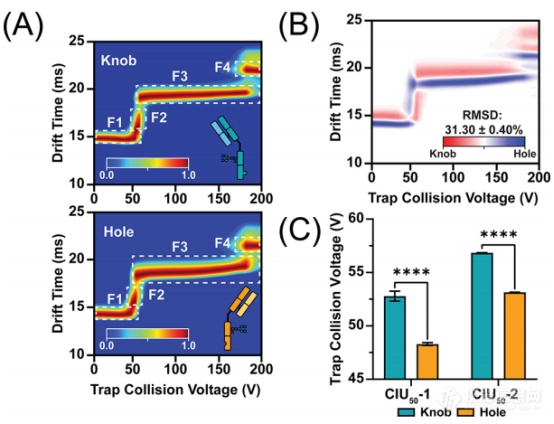
图2 knob和hole的半体CIU数据。(A)16+电荷态的平均CIU指纹图谱(n=3).(B)两两RMSD分析显示,半体之间的高级结构存在显著差异。(C)CIU50分析显示,蛋白质稳定性存在显著差异。
为了更好地展示KiH bsAb不同结构域的CIU特征,作者记录了同型二聚体单抗IM-MS光谱中16+电荷态的knob和hole半体的CIU数据。从图2A的指纹图谱可以看出,每种结构都包含4种主要的CIU特征,但是图2B的RMSD分析显示两种半体的高级结构之间存在显著差异。CIU50分析进一步表明,在观察到的两次展开过渡中,knob半体明显比hole半体更稳定。作者推测造成这种CIU主要差距的原因可能是Fab结构域的差异。
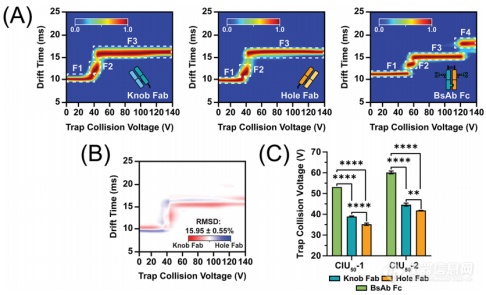
图3 Fab和Fc片段的CIU数据。(A)13+电荷态的平均CIU指纹图谱(n=3).(B)两两RMSD分析显示,knob和hole的Fab片段之间存在显著差异。(C)CIU50分析显示,不同片段之间稳定性存在显著差异。
为了进一步将CIU特征联系到KiH bsAb的结构域当中,作者对木瓜蛋白酶消化后产生的Fab和Fc片段进行了CIU分析。从图3A可以看出,knob和hole的Fab片段都具有3种CIU特征,但是嵌合的Fc片段则具有4种CIU特征。尽管knob和hole的Fab片段具有相似的CIU指纹图谱,但是RMSD分析显示它们之间的高级结构仍然存在较大差异,并且knob的Fab片段稳定性明显高于hole的。至于Fc片段的稳定性则远高于两种Fab片段,可能的原因是重链CH3结构域的强非共价作用以及knobs-into-holes配对的影响。
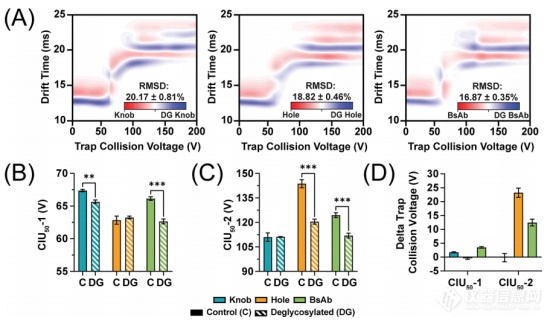
图4 去糖基化后的knob、hole同型二聚体和KiH bsAb异型二聚体24+离子(n=3)。(A)比较对照组和去糖基化抗体的RMSD分析显示,高级结构有显著差异。CIU50-1(B)和CIU50-2(C)分析显示抗体去糖基化后表现出显著的不稳定性。(D)对照组和去糖基化抗体之间的CIU50值差异图。
先前的研究已经证明,CIU对不同水平的单抗糖基化很敏感,其中去糖基化会导致单抗高级结构的不稳定。作者利用高分辨率非变性轨道阱质谱分辨添加PNGaseF前后同型二聚体mAb和KiH bsAb糖型的变化。实验结果显示,KiH bsAb表现出高度糖异质性,包含至少12种不同的糖型。这很可能归因于组装的KiH bsAb中每个独立的knob和hole重链上存在独特的糖基化,进一步增加了其复杂性。
总而言之,这篇文章展示了IM-MS结合CIU用于建立KiH bsAb及其亲本同型二聚体之间高级结构联系的能力。单独的CCS不足以解决此研究中抗体之间细微的高级结构差异。相比之下,CIU指纹图谱则可以分辨和区分每一个等截面的抗体。这一解释bsAb CIU细节的能力,加上对KiH bsAb稳定性的更深入理解,有可能提供支持KiH bsAb发现和发展的关键信息。
撰稿:梁梓欣
编辑:李惠琳
文章引用:Ion Mobility-Mass Spectrometry and Collision-Induced Unfolding of Designed Bispecific Antibody Therapeutics
李惠琳课题组网址www.x-mol.com/groups/li_huilin
参考文献
Villafuerte-Vega, R. C., Li, H. W., Slaney, T. R., Chennamsetty, N., Chen, G., Tao, L., & Ruotolo, B. T. (2023). Ion Mobility-Mass Spectrometry and Collision-Induced Unfolding of Designed Bispecific Antibody Therapeutics. Analytical Chemistry.
